Kimia Kelas XTO Pertemuan ke 8
BAB II
HIDROKARBON DAN MINYAK BUMI
A. Senyawa Hidrokarbon
Senyawa karbon sangat banyak jenisnya serta memiliki kegunaan yang beragam. Jika kita perhatikan dengan seksama, hampir semua bahan kimia yang digunakan dalam kehidupan sehari - hari merupakan golongan senyawa karbon. Banyaknya senyawa karbon di alam ini sangat berhubungan dengan karakteristik atom karbon.
1. Kekhasan Atom Karbon
Karbon merupakan senyawa nonlogam yang terletak dalam golongan IVA dan periode 2 dalam sistem periodik usur. Karbon berasal dari kara carbon sehingga memiliki lambang C. Karbon memiliki nomor atom 6 dan nomor massa 12. Di alam atom karbon terdapat sebagai isotop 12C, 13C, dan 14C.
Berdasarkan beberapa sifat tersebut, maka atom karbon memiliki beberapa karakteristik atau keunikan sehingga mudah membedakannya dengan unsur yang lain, antara lain sebagai berikut.
a. Atom Karbon memiliki 4 elektron valensi
Karbon merupakan satu - satunya unsur yang dapat membentuk ikatan kovalen sebanyak empat buah. Hal ini dikarenakan berdasarkan konfigurasi elektronnya, atom karbon memiliki elektron valensi 4 buah. Oleh karena itu, untuk mencapai kestabilannya atom karbon berikatan kovalen. Senyawa hidrokarbon yang mengikat empat atom hidrogen adalah metana. Metana memiliki rumus CH4.
b. Atom Karbon Dapat Membentuk Rantai Karbon
Atom karbon memiliki 4 elektron valensi maka atom karbon dapat membentuk rantai karbon yang dapat berikatan dengan atom karbon yang lain. Dalam membentuk rantai karbon atom C dapat menyumbangkan 1,2,3 sampai 4 elektron valensinya untuk dapat dipakai bersama dengan atom - atom C lainnya. Berdasarkan jumlah atom C yang terikat pada atom C lainnya, terdapat 4 (empat) kemungkinan posisi atom C dalam rantai karbon, sebagai berikut.
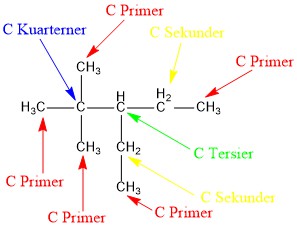
1) Atom C primer, yaitu atom C yang mengikat satu atom C lainnya.
2) Atom C sekunder, yaitu atom C yang mengikat dua atom C lainnya.
3) Atom C tersier, yaitu atom C yang mengikat tiga atom C lainnya.
4) Atom C kuarterner, yaitu atom C yang mengikat empat atom C yang lain.
Contoh menentukan C primer, sekunder, tersier, dan kuarterner
c. Jari - jari atom Unsur Karbon Relatif Kecil
Berdasarkan konfigurasi elektronnya, maka dapat diketahui bahwa atom karbon terletak pada periode 2 yang berarti memiliki jumlah kulit sebanyak dua buah. Hal ini tentu saja membuat jari - jari atomnya berukuran kecil. Jari - jari atom karbon yang kecil ini membuat letak inti dan elektron valensi cukup dekat, sehingga memiliki gaya tarik - menarik yang cukup kuat. Gaya tarik - menarik tersebut yang membuat ikatan rantai karbon menjadi kuat, sehingga tidak mudah putus, karena gaya tarik menarik inti yang membuat atom karbon dapat membentuk ikatan rangkap dengan rantai karbon yang lain.

Komentar
Posting Komentar